ベストアンサー
炭素の原子番号は6です。したがって、炭素原子として知られる原子の場合、 6つの陽子が必要です。たとえば、原子に7つの陽子がある場合、炭素ではなく、中性子になります。陽子が6つない原子は炭素ではありません。
中性に帯電するには、電子の量が原子内の陽子の数と同じである必要があります。したがって、電子の数も6 である必要があります。
ただし、の数中性子は同位体によって異なります。炭素の同位体は特定の種類の炭素です。たとえば、6つの中性子を持つ炭素12を使用できます。炭素13には7個の中性子があり、炭素14には8個の中性子があります。
原子内の中性子の数を見つける簡単な方法は、原子量を調べてその数を引くことです。それからの陽子の。たとえば、原子の原子質量が11で、原子に6つの陽子があることがわかっている場合、11から6を引くと、5になります。これで、中性子が5つあることがわかります。これが機能するのは、陽子と中性子がそれぞれ約1 amuであるのに対し、電子は非常に軽いため、通常は多くの計算に影響を与えないためです。
回答
これは
構造原理。これは、そこにある電子の数に基づいて、どの軌道が電子によって占められるかを指定する原理です。つまり、n個の電子が最も低いエネルギーを必要とするn個の軌道を埋めようとするということです。
炭素は原子番号6の元素です。つまり、イオン化されていない場合、6個の電子があります。
最初の2つの電子は、最初の(最も内側の)シェルの2s軌道を満たします。
これにより、2番目のシェルに4つの電子が残ります。 、これ以上ないので、最も外側のシェルです。これらの2番目の殻軌道は原子核から最も遠い軌道であるため、これらは化学結合を形成するときに他の原子が相互作用するために利用できる軌道です。そのため、最も外側のシェルは価電子であり、任意の時点でそれを占める電子は価電子です。 (「原子価」は「力」を意味し、「力を組み合わせる」という意味で、新しい組み合わせや結合を作る能力です。)
この図を見てください。この図は内殻が完全に飲み込まれている様子を示しています。外殻、したがって化学相互作用にアクセスできない:
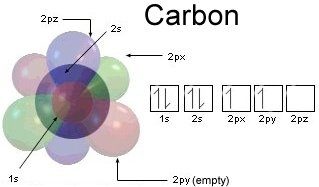
この図は、 p軌道はどういうわけか区別可能であるか、または電子はどういうわけか自分自身を正確に1つの軌道に永久に閉じ込めます。実際、電子自体は区別がつかず、オーフバウの原理に長期的に違反することなく移動する限り、軌道間を自由に移動できます。言い換えれば、基底状態の非イオン化炭素原子は常に22s電子と22p電子を持っていると言えますが、どちらかとは言えません。 p軌道は占有されています—電子はそれが賢明な質問であるように振る舞わないだけです。