정답
탄소는 원자 번호 6을 가지고 있습니다. 따라서 원자는 탄소 원자로 알려져 있습니다. , 6 개의 양성자가 있어야합니다. 예를 들어 원자에 양성자가 7 개인 경우 더 이상 탄소가 아닌 대신 질소가됩니다. 6 개의 양성자가없는 원자는 탄소가 아닙니다.
전자의 양은 원자의 양성자 수와 같아야 중성으로 충전됩니다. 따라서 전자 수도 6 이어야합니다.
그러나 중성자는 동위 원소에 따라 다를 수 있습니다. 탄소 동위 원소는 특정 유형의 탄소입니다. 예를 들어 6 개의 중성자가있는 탄소 -12를 가질 수 있습니다. 탄소 -13은 중성자 7 개, 탄소 -14는 중성자 8 개 등으로 구성됩니다.
원자에서 중성자 수를 찾는 쉬운 방법은 원자 질량을보고 숫자를 빼는 것입니다. 그것으로부터 양성자의. 예를 들어, 원자의 원자 질량이 11이고 원자에 6 개의 양성자가 있다는 것을 알고 있다면 11에서 6을 빼서 5를 얻을 수 있습니다. 그러면 5 개의 중성자가 있다고 말할 수 있습니다. 이것은 양성자와 중성자가 각각 약 1amu이고 전자는 매우 가볍기 때문에 일반적으로 많은 계산에 영향을 미치지 않기 때문에 작동합니다.
Answer
Aufbau 원칙 . 이것은 얼마나 많은 전자가 있는지에 따라 전자가 차지할 궤도를 지정하는 원리입니다. 이는 n 개의 전자가 가장 낮은 에너지를 필요로하는 n 개의 궤도를 채우려 고 할 것이라는 결론으로 귀결됩니다.
탄소는 원자 번호 6을 가진 원소입니다. 즉, 이온화되지 않은 경우 6 개의 전자를가집니다. 6 개의 양성자의 전하 균형을 맞 춥니 다.
처음 두 개의 전자는 첫 번째 (가장 안쪽) 껍질의 2s 궤도를 채 웁니다.
그러면 두 번째 껍질에 4 개의 전자가 남습니다. 는 더 이상 없기 때문에 가장 바깥 쪽 셸입니다. 이 두 번째 껍질 궤도는 핵에서 가장 먼 궤도이기 때문에 화학 결합을 형성 할 때 다른 원자와 상호 작용할 수있는 궤도입니다. 그렇기 때문에 가장 바깥 쪽 껍질은 원자가 껍질이고 주어진 순간에 원자가 전자를 차지하는 전자입니다. ( “밸런스”는 “파워”를 의미하며, “파워”를 의미하며 새로운 조합과 결합을 만들 수있는 능력입니다.)
내부 껍질이 어떻게 완전히 휩싸이는지를 보여주는이 다이어그램을 살펴보십시오. 따라서 화학적 상호 작용에 접근 할 수 없습니다.
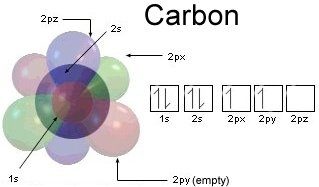
이 다이어그램은 p 궤도는 어떻게 든 구별 가능하거나 전자가 어떻게 든 정확히 하나의 궤도에 영원히 국한됩니다. 사실, 전자 자체는 구별 할 수 없으며 Aufbau 원리를 장기간 위반하지 않는 한 궤도 사이를 자유롭게 이동할 수 있습니다. 즉, 바닥 상태의 이온화되지 않은 탄소 원자에는 항상 2 개의 2s 전자와 2 개의 2p 전자가 있다고 말할 수 있지만 p 궤도는 점유되어 있습니다. 전자는 그저 물어볼 수있는 합리적인 질문으로 행동하지 않습니다.